| пн-пт | 08:00-21:00 |
| сб | 08:00-19:00 |
Двуликий XII фактор и как узнать Хагемана?
Автор - Главный врач НКЦПГ им. А.А. Шмидта, к.м.н., врач высшей квалификационной категории Альтшулер Б.Ю.
История вопроса
Так ли просто определить АЧТВ?
В чем особенность фактора свертывания XII?
Виновата генетика
Риски дефицита фактора свертывания XII и сопутствующие нарушения
Клинический случай гомозиготной формы болезни Хагемана
Что же с этим делать?
Вы можете скачать ПРЕЗЕНТАЦИЮ к статье.
История вопроса
Фактор свертывания XII был открыт в 1954 году американским гематологом Oскаром Ратнофф при обследовании 37-летнего железнодорожного рабочего Джона Хагемана. В лабораторных тестах этого пациента было значительно замедлено свертывание крови, но при этом не было никаких клинических признаков кровоточивости. Ранее он успешно перенес операцию, которая также не сопровождалась чрезмерным кровотечением.
Совместно с биохимиком Эрлом Дэви Ратнофф установил, что в крови Джона Хагемана отсутствовал некий белок. По имени пациента Ратнофф назвал этот белок фактором Хагемана. К этому времени были уже открыты и другие факторы свертывания. Поэтому фактор Хагемана получил очередной порядковый номер и был назван 12 фактором свертывания (обозначается латинскими цифрами XII).
Умер впоследствии Джон Хагеман не от кровотечения, а от тромбоэмболии легочной артерии на фоне длительной иммобилизации после перелома костей таза.
Дефицит фактора свертывания XII и сопутствующая ему клиническая картина получили название болезни Хагемана.
Так ли просто определить АЧТВ?
Чаще всего с дефицитом XII-го фактора свертывания сталкиваются при рутинных медицинских обследованиях, сдаче плановых анализов, например, так называемого госпитального комплекса. В такие анализы входит и обычная коагулограмма, предусматривающая определение протромбинового времени, АЧТВ и фибриногена.
Дефицит XII-го фактора проявляется удлинением активированного частично тромбопластинового времени (АЧТВ), которое может быть значительным. Если такому пациенту предстоит операция, то хирурги, видя удлинение АЧТВ и опасаясь повышенной кровоточивости, требуют дополнительного обследования пациента и консультации гематолога, отказываясь оперировать таких пациентов до выяснения причин. Такова стандартная клиническая практика.
Дальше все зависит от возможностей лаборатории понять, с чем именно связано удлинение АЧТВ.
Теоретически удлинение АЧТВ может вызываться многими причинами. В первую очередь, это дефицит факторов внутреннего пути свертывания крови, к которым относятся факторы VIII, IX, XI и XII. Значительно реже это может быть связано с глубоким дефицитом факторов V и X, которые находятся на пересечении внутреннего и внешнего путей свертывания крови. Однако самая частая причина удлинения АЧТВ – это дефицит XII-го фактора свертывания крови.
Также АЧТВ может удлиняться в присутствии волчаночного антикоагулянта и антифосфолипидных антител. В этом случае удлинение АЧТВ значительно зависит от чувствительности используемых реагентов к антифосфолипидным антителам.
Удлинение АЧТВ может быть различным не только в присутствии антифосфолипидных антител, но и на фоне дефицита факторов внутреннего пути свертывания, в том числе фактора XII. Это тоже связано с разной чувствительностью используемых реагентов.
Одни тест-системы проявляют большую чувствительность к удлинению АЧТВ, другие равно чувствительны как к удлинению, так и к укорочению этого показателя. Напомним, что удлинение АЧТВ указывает на повышенный риск геморрагического синдрома, тогда как укорочение АЧТВ характерно для активации внутреннего пути свертывания и риска тромбоза.
Важно знать, что если удлиняться АЧТВ может значительно, иногда на десятки секунд, то укорачивается оно лишь на несколько секунд.
Таким образом, значительное увеличение риска геморрагического синдрома, обусловленное, например, многократным, на десятки процентов, снижением активности факторов свертывания, будет проявляться удлинением АЧТВ на несколько десятков секунд.
Но столь же значительное и более опасное для здоровья и жизни пациента повышение риска тромбоза, связанное с активацией внутреннего пути свертывания, будет проявляться на порядок меньшим изменением АЧТВ – с его укорочением всего на несколько секунд даже при использовании самых чувствительных тест-систем.

Об этой особенности АЧТВ нужно обязательно помнить, придавая даже незначительному его укорочению серьезное значение. Также нужно знать, что многие тест-системы, проявляя высокую, иногда избыточную чувствительность к удлинению АЧТВ, практически никогда не выявляют его укорочение, оказываясь неспособными определить даже значительную активацию внутреннего пути свертывания.
Поэтому если одному и тому же пациенту одномоментно определить АЧТВ в нескольких лабораториях, результаты могут значительно отличаться. Также могут различаться и результаты, полученные в разное время, ведь причины, ведущие к удлинению или укорочению АЧТВ, например, активность факторов свертывания, не бывают абсолютно неизменными. Понятно, что при сохранении проблемы, например, дефицита или избытка факторов внутреннего пути, присутствия антифосфолипидных антител, результаты определения АЧТВ останутся смещены в ту или другую сторону. Но с предыдущими результатами или с результатами, полученными в другой лаборатории, они могут не совпадать и иногда значительно.
Этому не надо удивляться и это не проявление лабораторной ошибки, а особенность использованных реагентов или естественной биологической вариации. До настоящего времени стандартизация определения АЧТВ во всем мире остается еще нерешенной задачей.
В нашей лаборатории используется тест-система, чувствительная как к удлинению АЧТВ, так и к его укорочению, что позволяет выявлять риски тромбоза, связанные с активацией внутреннего пути свертывания.
В чем особенность фактора свертывания XII?
Теперь вернемся к упомянутому XII фактору свертывания крови. Чем он интересен? Тем, что помимо запуска свертывания крови по так называемому внутреннему или контактному пути, XII-й фактор играет еще одну очень важную роль, которая заключается в активации фибринолитической системы.
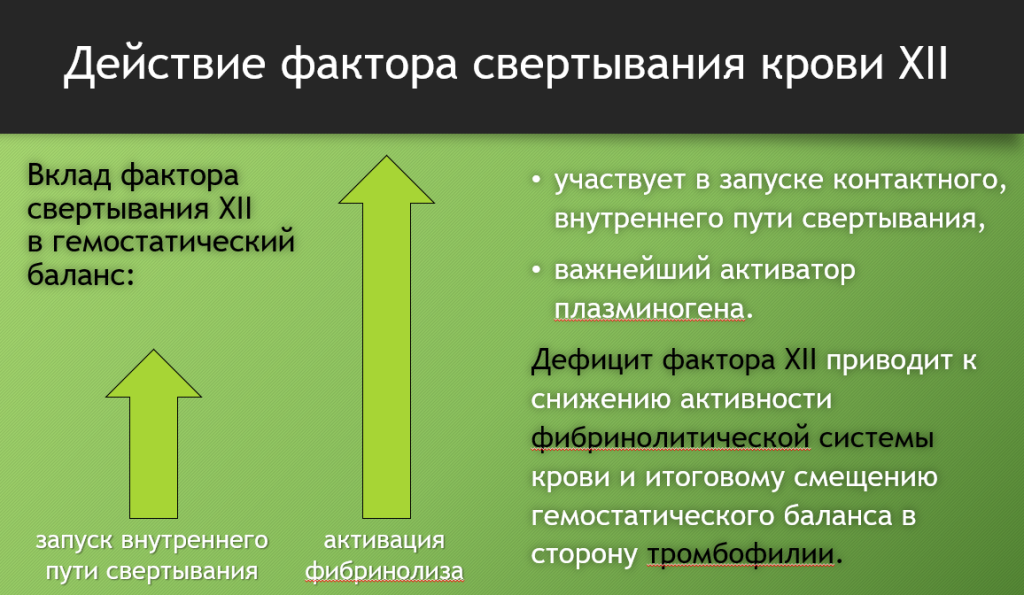
Фактор свертывания XII напрямую активирует плазминоген, превращая его в плазмин, основной фермент фибринолитической системы крови. А уже плазмин разрушает фибрин – нерастворимый белок, который является основным структурным компонентом тромба.
Скорость, с которой XII-й фактор активирует плазминоген, превращая его в плазмин, примерно в 10 раз меньше, чем у тканевого и урокиназного активаторов плазминогена. Но молярная концентрация XII-го фактора в крови в 5000 раз больше, чем у тканевого и урокиназного активаторов. То есть он менее активен, чем они, но просто его очень много. Интересно, что по своей химической структуре XII-й фактор свертывания очень похож и, как было установлено, эволюционно связан с тканевым активатором плазминогена.
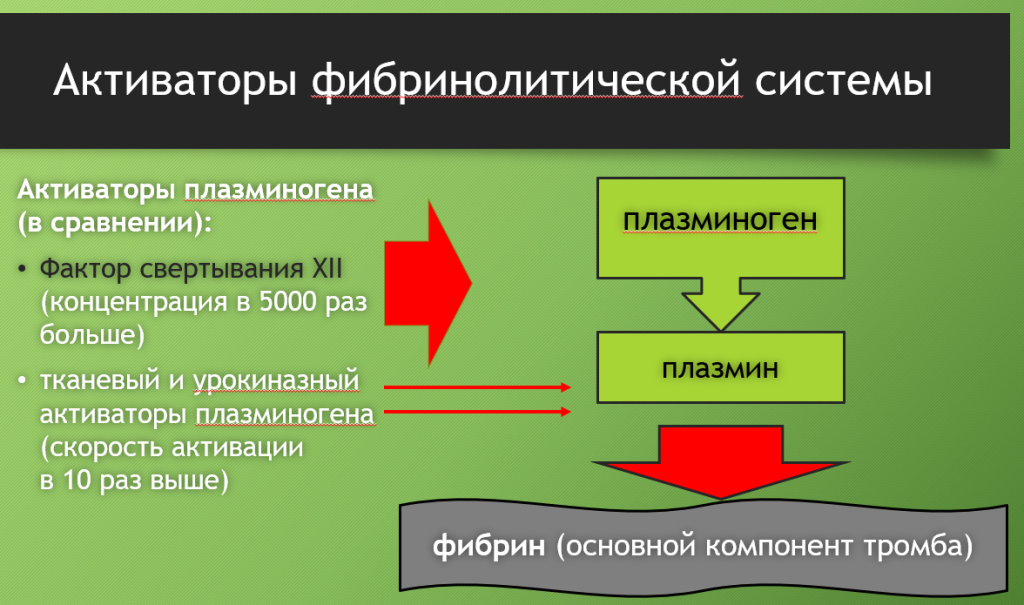
В результате именно XII-й фактор можно признать основным активатором фибринолитической системы крови. Как минимум он играет в процессе фибринолиза очень важную роль. В отсутствие XII-го фактора скорость фибринолиза резко падает и, соответственно замедляется разрушения фибрина.
Таким образом, дефицит фактора XII одновременно может приводить как к повышению риска тромбозов (так как снижается фибринолитическая активность крови), так и к повышенной кровоточивости (так как замедляется внутренний, контактный путь свертывания крови).
Одновременное повышение рисков тромбоза и повышенной кровоточивости воспринимается как парадокс, но наш организм устроен так, что это не противоречит друг другу. Возможны нарушения, когда у одного и того же человека одновременно и значительно статистически повышаются как риск тромбоза, так и риск развития геморрагического синдрома. Но в зависимости от активности XII-го фактора эти риски могут быть различны.
Неверно полагать, что по мере снижения активности XII-го фактора риск тромбоза и риск кровотечения будут возрастать одинаково и равномерно – это не так и это не синхронный процесс. Например, при какой-то активности XII-го фактора риск тромбоза может повышаться больше, чем риск кровотечения и наоборот.
Дефицит фактора свертывания XII – это нередкое состояние. Согласно медицинской статистике от 2 до 3% населения имеет дефицит XII-го фактора свертывания. Чаще всего это состояние обусловлено генетически, но, реже, может быть и приобретенным.
XII-й фактор свертывания относится к классу сериновых протеаз. Его молекула представлена полипептидной цепью из 596 аминокислотных остатков с массой около 8 кДа. Синтез XII-го фактора свертывания кодируется одним геном, который расположен в 5-й хромосоме в локусе 5q33 и состоит из 14 экзонов и 13 интронов. Напомним, что факторы свертывания, как и все белки, за исключением иммуноглобулинов, синтезируются в печени.
К настоящему времени описано уже 43 мутации (полиморфизмов) в гене XII-го фактора свертывания. Их появление приводит к нарушению выработки фактора или снижению его активности.
Наиболее часто встречается полиморфизм 46C/T, который характеризуется заменой цитозина на тимин в позиции 46 в 1-м экзоне и ведет к снижению синтеза XII-го фактора. При таком генетическом дефекте печень синтезирует меньшее количество XII-го фактора при том, что его молекулы структурно и по функциональным характеристикам совершенно нормальны. Наследование этой мутации в основном аутосомно-рецессивное, в единичных более тяжелых случаях — аутосомно-доминантное.
При гетерозиготной мутации – она обозначается С/Т – наблюдается частичное снижение активности XII-го фактора свертывания. Как правило, при генотипе С/Т активность XII-го фактора составляет от 10 до 50%. При гомозиготной мутации, которая обозначается как Т/Т, активность XII-го фактора составляет менее 10% – вплоть до неопределяемых величин.
Наблюдаемое удлинение АЧТВ в какой-то мере пропорционально снижению активности фактора XII, но без линейной зависимости. Неверно полагать, что, на сколько снижена активность XII-го фактора, настолько же пропорционально будет удлиняться АЧТВ – такой зависимости нет. Кроме того, как мы уже говорили, это зависит и от чувствительности используемых для определения АЧТВ реагентов.
Тем не менее, у носителей гомозиготной мутации гена, кодирующего синтез XII-го фактора свертывания, когда его активность падает намного меньше 10%, удлинение АЧТВ может быть очень и очень значительным. В этом случае АЧТВ может составлять 100-200 сек и более, свертывание крови при определении АЧТВ практически не происходит.
Обращаю ваше внимание, что по результатам некоторых исследований гомозиготную мутацию гена фактора свертывания XII может иметь 0,05-0,1% (по другим данным до 0,3%!) популяции.
При исследовании фибринолитической активности плазмы крови время XIIа-зависимого лизиса эуглобулинового сгустка также удлиняется. Если в норме это время составляет от 5 до 12 мин, то при активности XII-го фактора свертывания на уровне 10-50% оно удлиняется до 20-40 мин. При активности XII-го фактора менее 10% время XIIа-зависимого лизиса эуглобулинов время (XIIа-зависимого фибринолиза) может измеряться часами.
Итак, какие результаты лабораторных исследований будут наблюдаться у пациента с дефицитом XII-го фактора свертывания?
У пациентов с гетерозиготной мутацией (генотип С/Т) АЧТВ будет удлиняться от 30-35 до 50-70 секунд, активность XII-го фактора составит 10-50%, а время XIIа-зависимого лизиса эуглобулинов 20-40 минут.
У пациентов с гомозиготной мутацией (генотип Т/Т) АЧТВ будет удлиняться от 80-100 секунд до неопределяемых величин, активность XII-го фактора составит 0-10%, а время XIIа-зависимого лизиса эуглобулинов будет измеряться часами.

Риски дефицита фактора свертывания XII и сопутствующие нарушения
Неверно считать, что дефицит XII-го фактора свертывания проявляется исключительно повышением риска тромбозов. У таких пациентов одновременно повышается как вероятность тромбозов, так и риск развития геморрагического синдрома. Степень возникающих рисков зависит от глубины описанных нарушений и сопутствующих факторов. Например, повышенная кровоточивость может не проявляться в быту, при небольших травмах, но усугубляться при хирургических вмешательствах на обильно васкуляризированных тканях и большом операционном поле.
Мы уже упоминали, что к удлинению АЧТВ может приводить не только дефицит факторов внутреннего пути свертывания, в частности XII-го, но и появление в плазме крови антифосфолипидных антител. При таком состоянии, характерном для антифосфолипидного синдрома (АФС), в крови могут появляться антитела, направленные также и против XII-го фактора свертывания. Поэтому при обнаружении антифосфолипидных антител (например, антител к кардиолипину, β2-гликопротеину, аннексину, протромбину, фосфатидил-серину, фосфатидилсерин-протромбиновому комплексу), присутствии в крови волчаночного антикоагулянта также может наблюдаться и резкое снижение активности XII-го фактора. В этом случае необходимо выявление таких специфических, направленных против XII-го фактора свертывания антител, которые рассматриваются как его ингибиторы.
Как мы уже говорили, дефицит XII-го фактора свертывания ведет к значительному снижению фибринолитической активности крови. Это закономерно рассматривается как причина повышения протромботического потенциала крови и смещения гемостатического баланса в сторону тромбофилии.
А что еще может часто приводить к замедлению фибринолиза? И могут ли такие нарушения сочетаться с дефицитом XII-го фактора свертывания?
В плазме крови присутствуют вещества, которые называются ингибиторы активатора плазминогена. В литературе они обозначатся английскими буквами PАI (plasminogen activator inhibitor). Существуют ингибиторы активатора плазминогена 1-го, 2-го и 3-го типа.
Ингибитор активатора плазминогена 1-го типа (PAI-1) обнаруживается и в плазме крови и тромбоцитах. Синтезируется он в эндотелиальных клетках. Он ингибирует тканевый и урокиназный активаторы плазминогена, тем самым подавляя образование плазмина. Одновременное повышение содержания в крови ингибитора активатора плазминогена 1-го типа и уменьшение активности XII-го фактора свертывания ведет к резкому снижению фибринолитической активности крови и еще большему риску тромбоза.
Ингибитор активатора плазминогена 2-го типа (PAI-2) также в небольшом количестве присутствует в плазме крови. В нормальных условиях его там содержится намного меньше, чем ингибитора активатора плазминогена 1-го типа (PAI-1).
Ингибитор активатора плазминогена 2-го типа синтезируется плацентой и при беременности его концентрация в плазме крови повышается в десятки раз. При беременности, хотя и намного меньше, в плазме крови повышается также и концентрация ингибитора активатора плазминогена 1-го типа. Но основное снижение фибринолитической активности крови при беременности происходит именно из-за ингибитора активатора плазминогена 2-го типа.
По мере развития беременности время XIIа-зависимого лизиса эуглобулинов постепенно увеличивается с 5-12 минут до 20-30 и даже 40 минут. Более чем наполовину характерное для беременности повышение свертываемости крови и повышение рисков ВТЭО связано именно со снижением фибринолитической активности крови.
Ингибитор активатора плазминогена 3-го типа имеет минорное значение, а оказываемые им эффекты пренебрежимо малы.
Надо знать, что ингибитор активатора плазминогена 1-го типа – это еще и острофазовый белок. Его синтез стимулируется липополисахаридами бактериальной стенки, бактериальным эндотоксином, провоспалительными цитокинами, интерлейкином-1 и ФНО. Поэтому при большинстве воспалительных реакций и бактериальных инфекций концентрация ингибитора активатора плазминогена 1-го типа в плазме крови резко повышается. Поэтому при любой воспалительной реакции наблюдается снижение фибринолитической активности крови. Чем активнее воспалительная реакция, тем больше замедляется фибринолиз.
Дефицит фактора свертывания XII на фоне выраженной воспалительной реакции, тяжелых бактериальных инфекций или у беременных должен расцениваться как опасное состояние. В таких случаях всестороннее исследование свертывающей системы крови, его грамотная оценка, адекватная профилактическая антикоагулянтная терапия становятся особенно актуальны.
В заключение коснусь молекулярно-генетических исследований, многие из которых уже стали рутинными. К сожалению, определение полиморфизма гена XII-го фактора свертывания, несмотря на распространенность его патологии в популяции, большинством гематологов не рассматривается как приоритетное в отличие от других генетических тестов. С учетом сказанного мы считаем, что, если в ходе молекулярно-генетического исследования выявлен полиморфизм гена, обуславливающий повышенное содержание ингибитора активатора плазминогена 1-го типа, желательно определить и активность XII-го фактора свертывания крови.
Клинический случай гомозиготной формы болезни Хагемана
Теперь разберем классический клинический случай пациента нашей клиники с гомозиготной формой болезни Хагемана.
Вот его анализы (подробнее см. ПРЕЗЕНТАЦИЮ). Итак, что мы видим?
1. Удлинение АЧТВ до фактически неопределяемых величин, о котором я уже говорил. Если нормальные значения АЧТВ в нашей лаборатории составляют от 23 до 32 сек, то у этого пациента АЧТВ около 300 сек, практически кровь в этом тесте не сворачивалась.
XII-й фактор свертывания практически не определялся (определяемая активность была менее 1%).
При этом в других тестах, например, в популярном исследовании тромбодинамики, мы видим абсолютно нормальные результаты. То есть если выполнить только исследование тромбодинамики и ограничится только им, чем грешат очень многие врачи, то заподозрить, что у пациента есть такое нарушение свертываемости крови, очень опасное нарушение - НЕВОЗМОЖНО! Для этого нет оснований – мы видим просто нормальные результаты.
2. Совершенно другие результаты нам дает тромбоэластометрия (тромбоэластография, ТЭГ). При выполнении этого исследования без активации внешнего или внутреннего путей, когда производится только рекальцификация плазмы крови, мы видим, что практически в течение часа свертывание крови не начинается – кровь не сворачивается. Параметр СТ, который, в частности, зависит от концентрации факторов свертывания, резко удлинен: при норме от 300 до 1000 секунд мы видим, что свертывание крови началось только через 3658 секунд. По сути, тромбоэластограф не смог продолжить исследование, которое в нашем случае было технически ограничено 60 минутами.
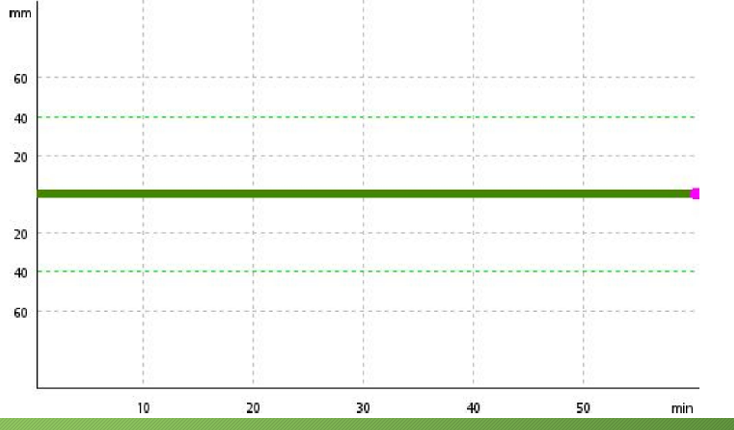
Если посмотреть на тромбоэластографию, характеризующую внешний путь свертывания, то там все абсолютно нормально. Потому что внешний путь свертывания крови от XII-го фактора никак не зависит.
Но когда мы исследуем методом тромбоэластометрии состояние внутреннего пути свертывания крови, мы видим резкое удлинение времени от запуска реакции до начала фибринобразования. В норме это время должно быть от 100 до 240 секунд. По графику это время 1747 сек – оно резко удлинено. Также удлинено время образования стабильного фибрина (интервал СFT), резко снижен угол α (касательная к графику свертывания). То есть мы видим резкое замедление как начальных процессов, которые заканчиваются появлением первых рыхлых элементов фибрина, так и процессов стабилизации фибрина, вообще всего процесса свертывания крови по внутреннему пути. Метод тромбоэластометрии в данном случае дает такую интересную и важную информацию.
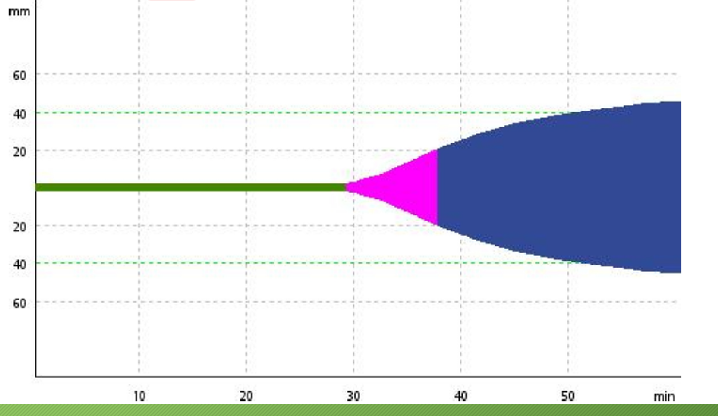
1. Что еще можно видеть у этого пациента применительно к этому состоянию? Если посмотреть на время XIIа-зависимого фибринолиза, то оно больше 180 мин. То есть за 3 часа ничего не произошло. Можно было ждать и дальше – 4-5 часов, но, скорее всего, фибринолиз так бы и не начинался. Потому что в этом тесте он запускается именно в присутствии XII-го фактора свертывания.
Какие клинические проявления, какую клиническую картину можно ожидать у такого пациента? Это крайне интересно. Во-первых, повышенный риск развития тромбоза. Сказать, что тут полностью заблокирован процесс фибринолиза, нельзя – помимо XII-го фактора существуют и другие активаторы фибринолиза. Но при появлении фибрина или тромбов их разрушение будет идти намного медленнее, многократно медленнее, чем в присутствии XII-го фактора свертывания. Поэтому риск тромбоза, как очевидно, резко возрастает. Одновременно (это можно видеть в исследовании методом тромбоэластометрии) повышается и риск кровотечений.
Смотрим на тромбоэластометрию без активации свертывающей системы крови (т.е. только после рекальцификации) - кровь не сворачивается! То же самое будет при элементарной бытовой травме (палец порезали, а свертываемость крови не происходит, или происходит сильно замедленно). Конечно, небольшие бытовые травмы в первую очередь останавливаются за счет тромбоцитарного гемостаза. Результат будет зависеть от объема травмы – от того, насколько васкуляризирована ткань, каков просвет сосудов, которые были повреждены.
Есть такое распространённое мнение, что у пациентов с болезнью Хагемана повышается только риск тромбоза, что их безопасно оперировать, потому что риска кровоточивости у них нет. Но, если посмотреть на результаты тромбоэластометрии этого пациента, то видно, что риск кровоточивости у него неизбежно будет повышен. Насколько практически, во сколько раз – конечно, сказать сложно, но он очевидно будет повышен. Поэтому, конечно, такого пациента брать на операцию без предварительной предоперационной подготовки очень рискованно.
Ситуация осложняется тем, что концентратов фактора XII для предоперационной подготовки для внутривенной инфузии не существует. Есть концентраты VII-го, VIII-го, IX-го факторов, фактора Виллебранда, но концентратов, содержащих только фактор XII, нет. Поэтому можно говорить только о переливании доз свежезамороженной плазмы. В литературе рекомендуется переливание 10-15 мл на 1 кг массы тела. Но учитывая количество XII-го фактора, которое надо восполнить, это конечно достаточно большие объемы для трансфузий. Решение должны принимать трансфузиологи и анестезиологи на этапе предоперационной подготовки.
Еще раз повторю: вопреки распространенному мнению, рассчитывать на то, что при выраженном дефиците XII-го фактора риск кровотечений во время операции и в послеоперационном периоде будет абсолютно минимальным, не стоит, особенно если мутация, которая к этому привела, гомозиготная. Если мы видим, что XII-й фактор практически не определяется, АЧТВ удлинено до неопределяемых значений, а в тесте XIIа-зависимого лизиса эуглобулинового сгустка не происходит в течение 2-3 часов – мы понимаем сразу же, ещё до генетического исследования, до определения полиморфизма гена XII-го фактора, что имеем дело с гомозиготной мутацией и, соответственно, со всеми этими рисками: повторюсь, одновременно с риском как тромбоза, так и повышенной кровоточивости.
От 2 до 3 % всего населения планеты имеет дефицит активности XII-го фактора в разной степени. Гомозиготная мутация встречается реже, чем гетерозиготная, поэтому чаще можно встретить дефицит XII-го фактора, активность которого составит от 20 до 60%. Активность XII-го фактора меньше 10% встречается значительно реже. По нашей оценке, вероятность гомозиготной мутации в 10-20 раз ниже, чем вероятность гетерозиготной. Но по опыту нашей клиники таких пациентов все равно очень много. Если спроецировать частоту такой патологии, например, на количество людей, проживающих в Москве и Московской области, а это около 15 миллионов человек, то масштаб проблемы сразу станет понятен: не меньше 300 000 человек имеет частичный дефицит XII-го фактора свертывания. И не меньше 15 000 человек только в Москве и МО имеет практически полный дефицит его активности, нуждаясь, как очевидно, в регулярном и квалифицированном наблюдении за своим состоянием.
В заключение еще немного эпидемиологии, раз уж мы ее коснулись. Просто чтобы стал понятен масштаб проблем, связанных с нарушениями в свертывающей системе крови, приведу еще один пример из медицинской статистики. Самым распространенным геморрагическим заболеванием признается болезнь Виллебранда. Частота дефектного гена фактора Виллебранда в популяции достигает 1:100 человек, из которых от 10 до 30% имеют клинические проявления. И это: дефицит активности XII-го фактора свертывания и болезнь Виллебранда – только две из множества патологий гемостаза…
В связи с этим считаем своей задачей обратить внимание медицинского сообщества и населения на серьезность и распространенность нарушений свертывающей системы крови и важность их правильной диагностики. Сложность и специфичность такой диагностики обусловлена особенностями системы гемостаза, ее динамичностью и множественными взаимосвязями. Это требует проведения исследований в специализированных медицинских центрах с применением комплексного подхода.




