| пн-пт | 08:00-21:00 |
| сб | 08:00-19:00 |
Исследование гемостаза у больных макроглобулинемией Вальденстрема
Автор статьи - Главный врач НКЦПГ им. А.А. Шмидта, к.м.н. Альтшулер Б.Ю.
Анализ лабораторных показателей и тактики обследования на примере клинического случая.
Содержание:
Краткая характеристика основного заболевания пациента
Что известно о нарушении гемостаза при макроглобулинемии Вальденстрема из литературных источников?
Клинический случай (основные результаты ранее проведенных обследований)
Что удалось обнаружить при расширенном обследовании?
Краткая характеристика основного заболевания пациента
Макроглобулинемия Вальденстрема – тяжелое онкогематологическое заболевание, относящееся к злокачественным моноклональным гаммапатиям.
Моноклональные гаммапатии – это собирательное наименование большой группы заболеваний, при которых происходит патологическая секреция измененных по своему химическому строению, молекулярной массе и иммунологическим свойствам иммуноглобулинов (гамма-глобулинов). Такие аномальные иммуноглобулины еще называют парапротеинами. Они образуются одним клоном плазматических клеток или B-лимфоцитов, склонных к постоянному неконтролируемому росту и размножению. Парапротеины нарушают функции практически всех органов и систем организма, приводя к развитию симптомов заболевания.
Морфологически макроглобулинемия Вальденстрема – это В-клеточная (лимфоидная) опухоль, состоящая из лимфоцитов, зрелых плазматических клеток и переходных клеточных форм. Одним из основных признаков макроглобулинемии Вальденстрема является секреция моноклональных парапротеинов, представленных Ig-M.
Это не распространенное заболевание (2% всех случаев В-клеточных лимфом). Болеют ей преимущественно мужчины старше 60 лет.
Помимо макроглобулинемии Вальденстрема к злокачественным моноклональным гаммапатиям относятся также миеломная болезнь, болезнь тяжелых цепей, плазмоцитома, В-клеточный хронический лимфолейкоз, диффузная В-клеточная лимфома, лимфома Беркитта, фолликулярная лимфома, В-клеточный пролимфоцитарный лейкоз, волосатоклеточный лейкоз, острый плазмобластный лейкоз и др.
Клинические проявления макроглобулинемии Вальденстрема обусловлены пролиферацией в костном мозге, селезенке, печени и лимфатических узлах лимфоцитов с накоплением в крови моноклональных Ig-M. Концентрация моноклональных Ig-M в крови при макроглобулинемии Вальденстрема может достигать 20-40 г/л.
Такая гиперпротеинемия с накоплением крупномолекулярных белков приводит к значительному повышению вязкости крови и увеличению СОЭ. При электрофоретическом исследовании сыворотки крови у больных макроглобулинемией Вальденстрема и другими моноклональными гаммапатиями в области гамма-фракции наблюдается т.н. М-градиент, площадь которого пропорциональна концентрации парапротеинов. В моче появляется белок Бенс-Джонса. У больных макроглобулинемией Вальденстрема наблюдается анемия и нейтропения, к которым со временем присоединяется тромбоцитопения.
Продолжительность жизни больных макроглобулинемией Вальденстрема при медленном развитии заболевания составляет 5-8 лет, но при быстрой прогрессии этот срок сокращается в 2-3 раза.
Что известно о нарушении гемостаза при макроглобулинемии Вальденстрема из литературных источников?
Как правило макроглобулинемию Вальденстрема сопровождает развитие коагулопатии, при которой возможны серьёзные нарушения гемостаза.
Нарушения в свертывающей системы крови при макроглобулинемии Вальденстрема не являются обязательными. Они не сопровождаются заранее предсказуемыми изменениями в работе регуляторных механизмов и содержании компонентов системы гемостаза. Поэтому при болезни Вальденстрема невозможно предсказать риск развития тромбоза или геморрагического синдрома только на основании клинической картины и руководствуясь клиническими рекомендациями. Оценка этих рисков требует углубленного лабораторного обследования.
Учитывая тяжесть основного заболевания и ослабленное состояние пациента, проводимую химиотерапию, очевидно, что риск развития летального исхода при присоединении тромбоза может быть очень высок. Чтобы исключить такое фатальное развитие событий, необходимо очень точно, детально понимать, что происходит у пациента со свертывающей системой крови и к чему это может привести. У таких пациентов нельзя исследовать свертывающую систему крови поверхностно или частично.
Клинический случай (основные результаты ранее проведенных обследований)
Рассмотрим изменения в системе гемостаза при макроглобулинемии Вальденстрема на примере клинического случая.
Пациент: мужчина, 57 лет. Состояние после одного курса химиотерапии. Основной диагноз: макроглобулинемия Вальденстрема. Сопутствующий диагноз: хроническая болезнь почек, 5-я стадия, ИБС, стенокардия напряжения 1-го функционального класса, дислипедемия. При лабораторном обследовании: гемоглобин – 75 г/л, эритроциты – 2,49 х 10*12/л, лейкоциты – 2,3 х 10*9/л, тромбоциты – 80 тыс/мкл, анизоцитоз, СОЭ – 1 мм/час, общий белок – 67,7 г/л, креатинин – 629 мкМ/л, мочевина – 20,7 мМ/л, ЛДГ – 213 Ед/л. Концентрация моноклональных Ig-M – 22 г/л, концентрация свободных лямбда-легких цепей – 7,13 г/л. Пункция костного мозга: 87% лимфоцитов. Спленомегалия, гепатомегалия. По данным ПЭТ/КТ повышение метаболической активности костного мозга в телах позвонков, ребрах, грудине, лопатках, костях таза. УЗ признаки тромбоза вен не выявлены.
В НКЦПГ им. А.А. Шмидта пациенту было проведено развернутое обследование системы гемостаза.
Какие изменения отмечаются у этого пациента в свертывающей системе крови?
«Нормальные результаты»
Результаты исследования тромбодинамики характерны для обычного здорового человека. Никакие из параметров исследования не указывают на риски тромбоза или геморрагического синдрома.
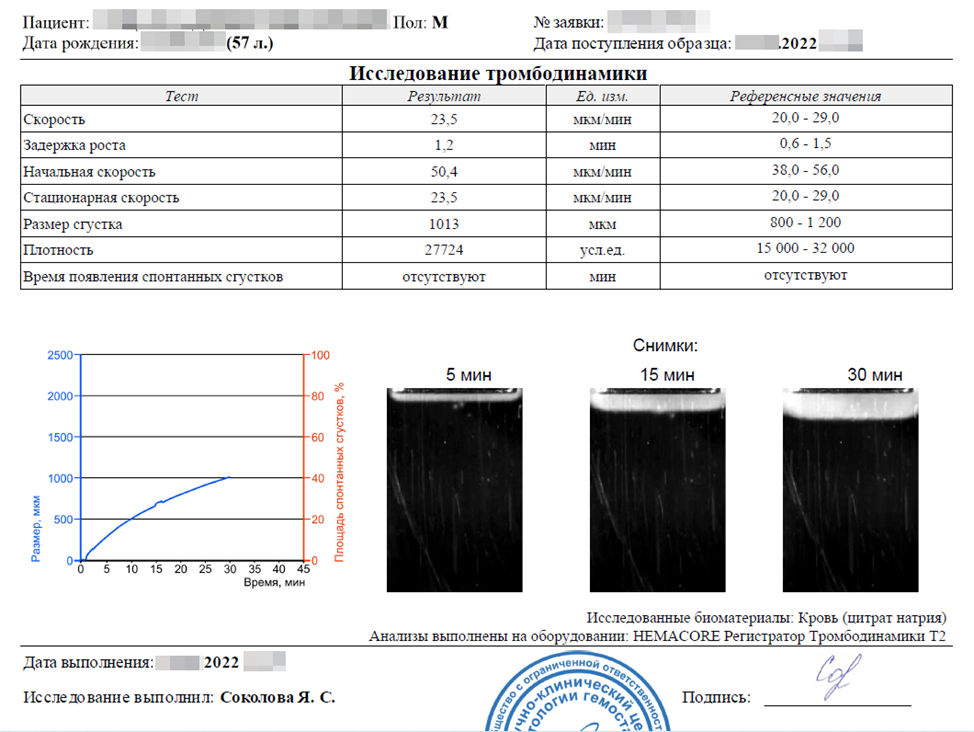
Почему это происходит и как могут маскироваться на фоне нормальных результатов различные коагулопатии, мы рассказывали на вебинаре, посвященном исследованиям тромбодинамики, и посвятили этому статью «Исследование тромбодинамики: обратная сторона медали».
Исследование методом ротационной тромбоэластографии также было малоинформативным.
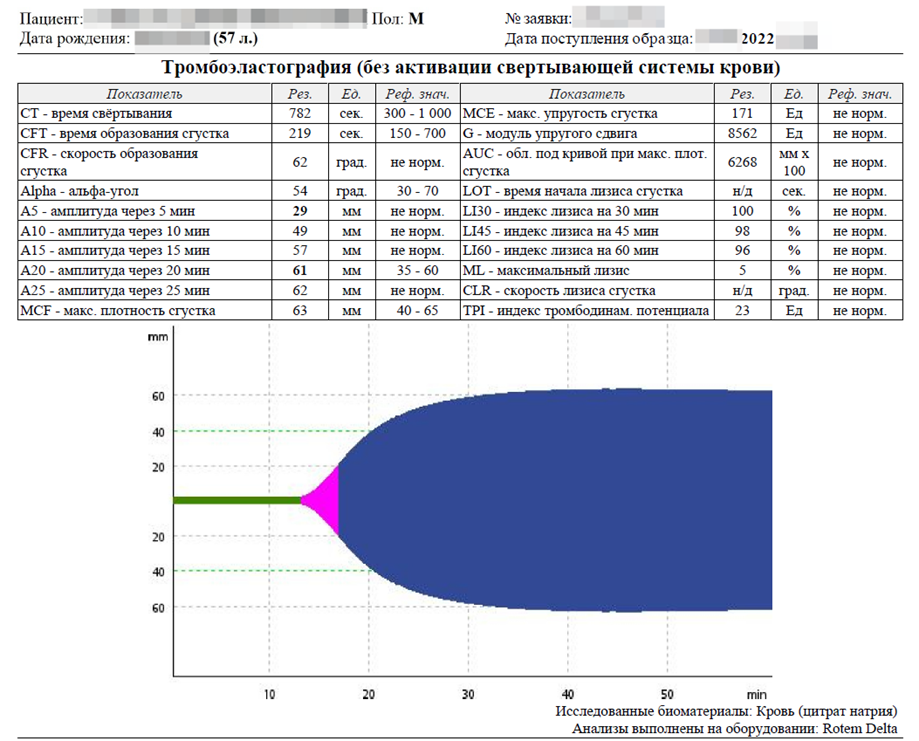
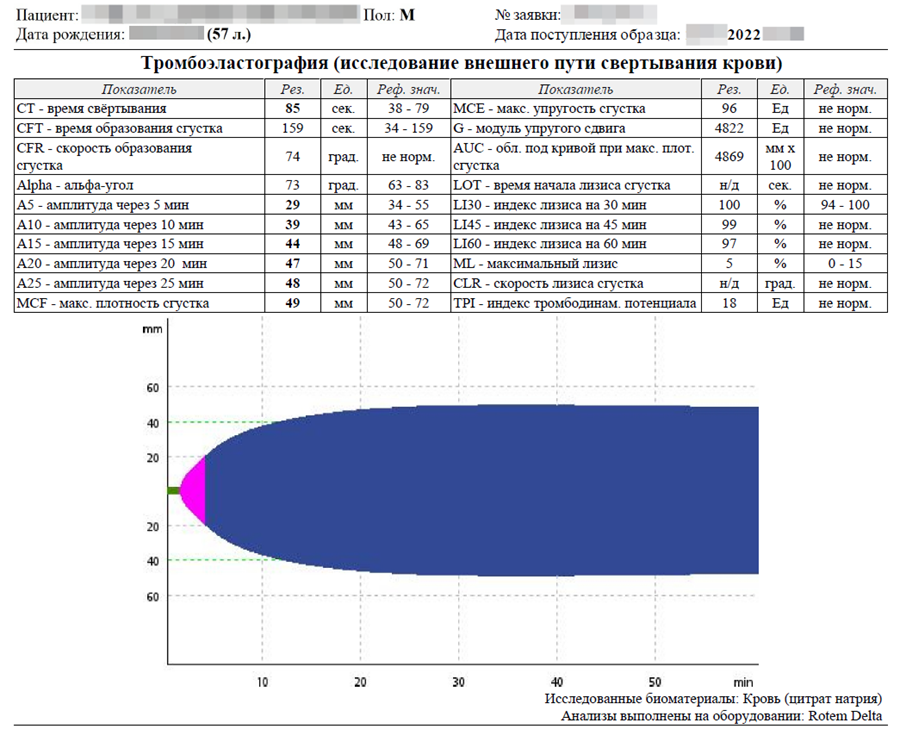
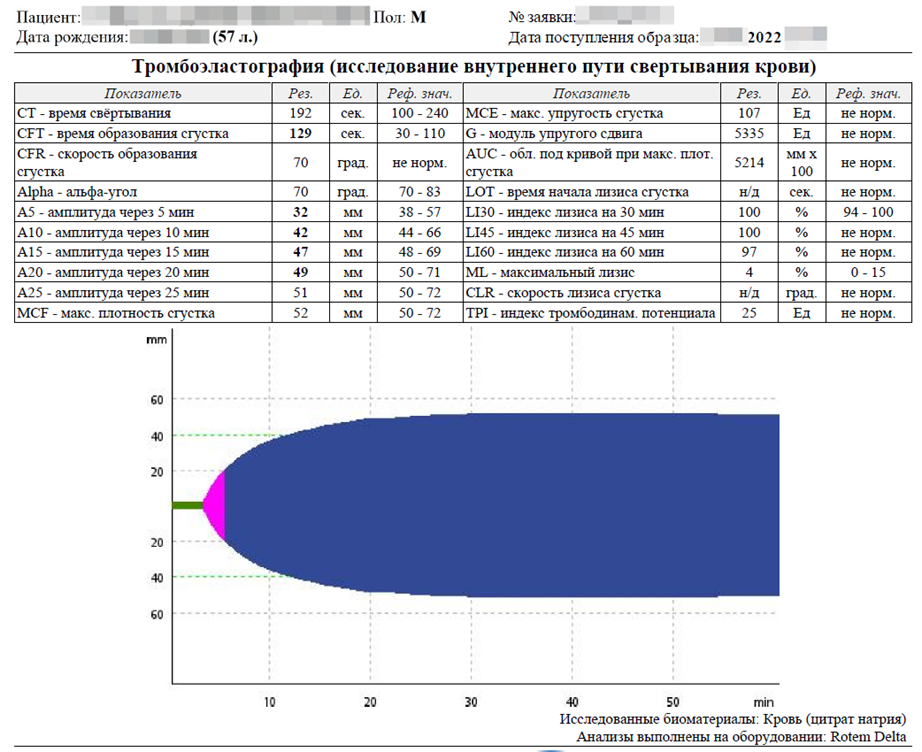
При исследовании без активации внутреннего или внешнего пути свёртывания можно предположить только повышенную концентрацию фибриногена.
После активации внутреннего и внешнего пути свёртывания наблюдается гипокоагуляция. Внешний вид тромбоэластограммы характерен для тромбоцитопении, которая наблюдается у пациента. Гиперфибриногенемия, тромбоцитопения, вероятное замедление фибринолиза. Другой информации тромбоэластография в данном случае не дает.
Исследование агрегации тромбоцитов, проведённое методом оптической агрегатометрии по Борну, демонстрирует замедление и умеренное снижение агрегантной активности тромбоцитов, повышенную скорость дезагрегации.
Это наблюдается со всеми типами индукторов. Причина в том, что парапротеины, которые присутствуют в большом количестве в крови пациента, сорбируясь на поверхности тромбоцитов, влияют на их агрегантную активность.
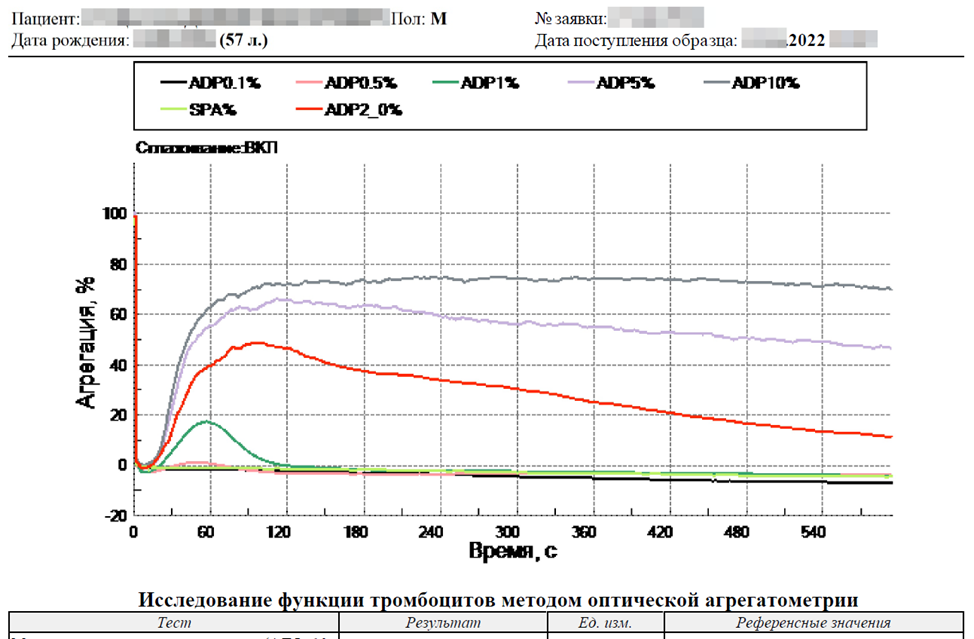
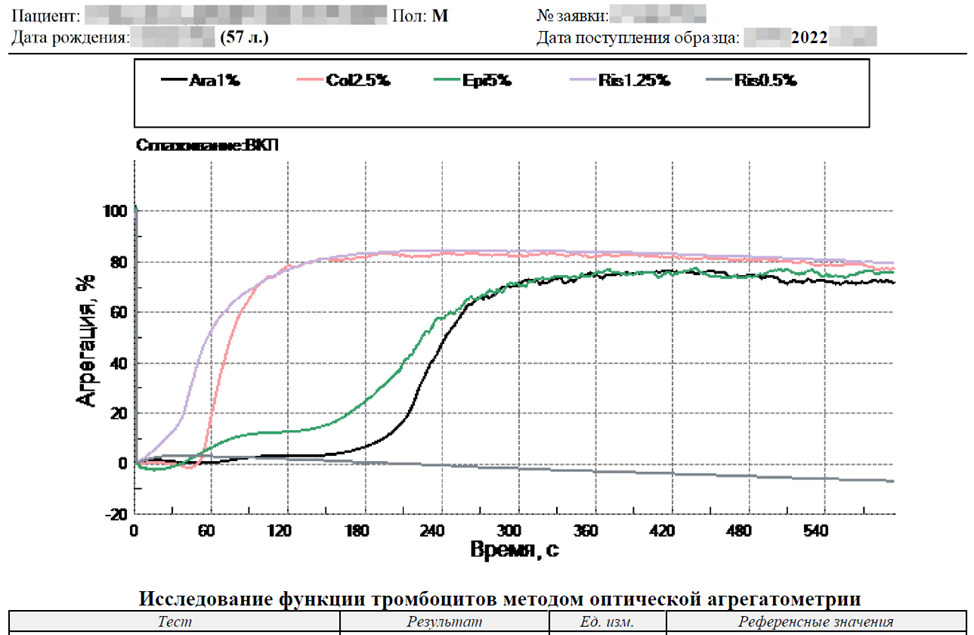
Обращаем Ваше внимание, что эти методы исследований в данном случае ничего не говорят о действительных рисках тромбоза или геморрагического синдрома!
Что удалось обнаружить при расширенном обследовании?
Намного более интересные результаты обнаруживаются при других исследованиях.
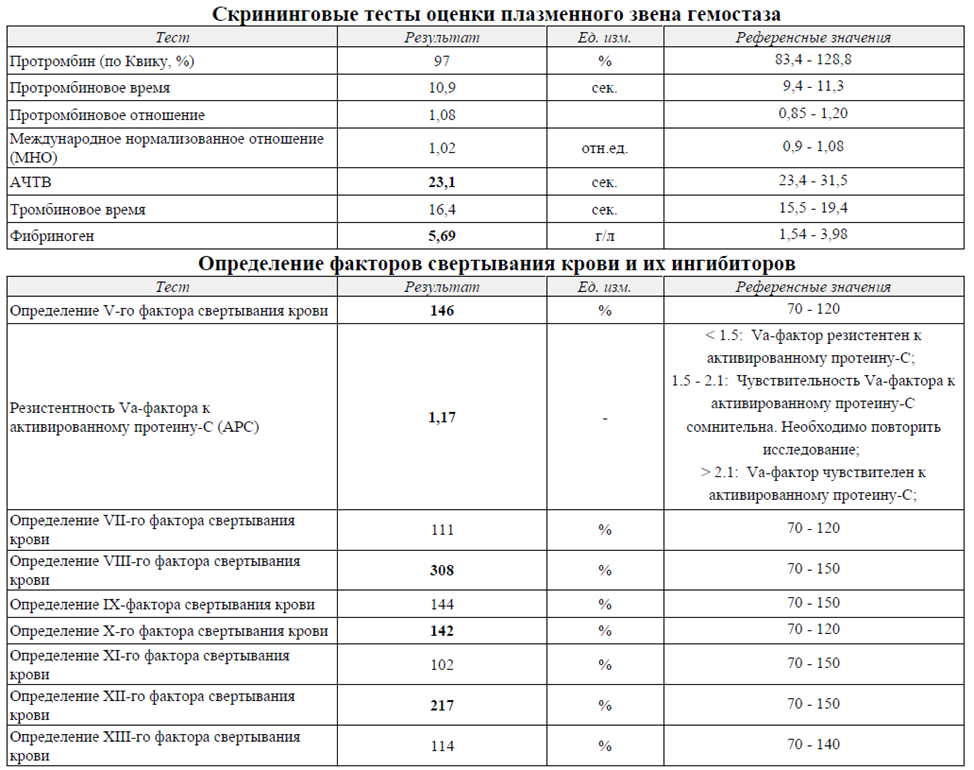
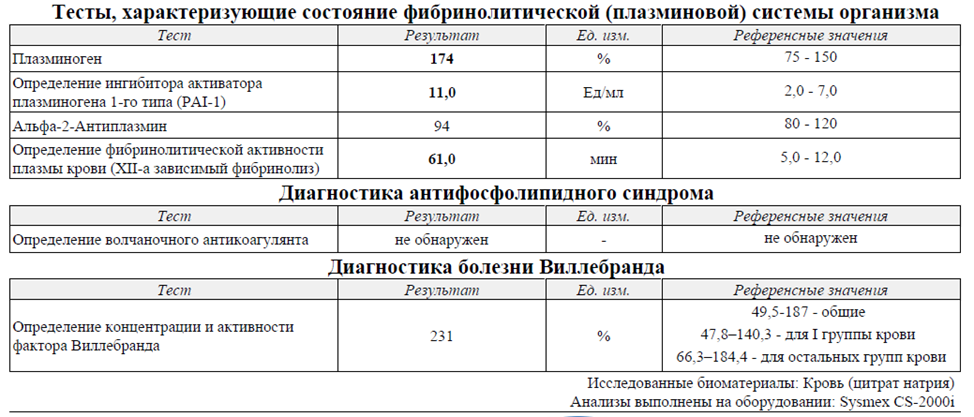
У пациента значительно повышена активность факторов свёртывания, укорочено активированное частичное тромбопластиновое время (АЧТВ). Укорочение АЧТВ указывает на активацию свёртывания крови по внутреннему пути.
Особое внимание стоит обратить на повышение активности факторов свертывания. Активность V-го и Х-го факторов свёртывания повышена примерно в полтора раза от средних популяционных значений, что не столь критично.
Активность VIII-го фактора свёртывания повышена свыше 300%. Напомним, что повышение активности VIII-го фактора свыше 150 процентов от среднего значения пятикратно повышает риск тромбоза.
Активность XII-го фактора свертывания – 217%. В сочетании с повышением активности V-го и Х-го факторов свёртывания это объясняет укорочение АЧТВ.
У пациента также повышена активность фактора Виллебранда (>230%). Это в два с половиной раза выше нормальных значений. Напомним, что повышение активности фактора Виллебранда - это протромботический компонент. Известно, что полуторакратное повышение активности фактора Виллебранда двукратно увеличивает риск венозных тромботических осложнений и развития ишемической болезни сердца.
Почему повышение активности фактора Виллебранда относится к протромботическим?
Помимо того, что фактор Виллебранда играет роль «молекулярного клея», способствущего адгезии и агрегации тромбоцитов, он защищает VIII-й фактор свёртывания от протеолитической деградации системой протеина С. Как известно, более 95% всех молекул VIII-го фактора свертывания связано с фактором Виллебранда.
Повышенное содержание фактора Виллебранда у пациента объясняет повышенную активность VIII-го фактора свертывания. Еще важнее то, к чему это приводит: у пациента наблюдается радикальное, кратное снижение антикоагулянтного потенциала системы протеина С. Одновременно с этим лабораторными методами регистрируется нечувствительность, резистентность V-го фактора свёртывания к активированному протеину C. Так же, как и при мутации Лейдена.
Почему это происходит? Высокая активность VIII-го и V-го факторов свёртывания приводит к тому, что «емкости» системы протеина С оказывается недостаточно для инактивации всех молекул V-го фактора, которые находятся в плазме крови.
В результате часть молекул VIII-го и V-го факторов свёртывания оказывается не заблокированной. В условиях лабораторного тестирования это проявляется индуцированной резистентностью и снижением антикоагулянтного потенциала системы протеина С.
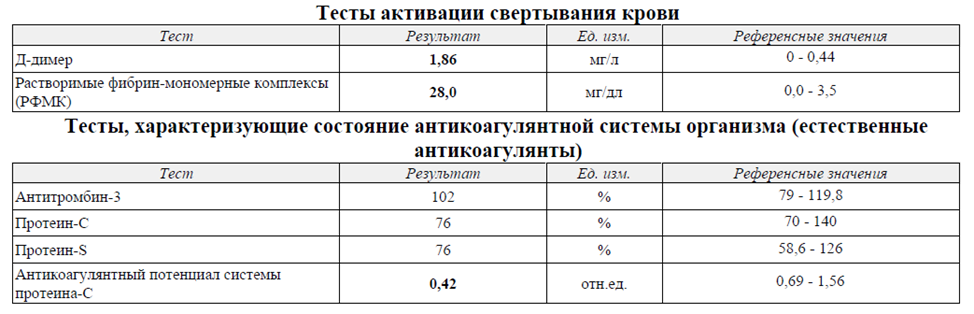
Помимо описанных изменений у пациента радикально, на порядок снижена фибринолитическая активность плазмы крови.
Снижение фибринолитической активности крови, которое замедляет лизис фибрина, рассматривается как важный протромботический фактор. Как известно, значительное повышение риска тромбоза наблюдается уже при 3-5-кратном снижении фибринолитической активности крови.
Попробуем суммировать то, что мы видим:
-
Гиперфибриногенемия и многократное повышение активности ключевых факторов свёртывания;
-
Снижение антикоагулянтного потенциала крови, обусловленное недостаточностью антикоагулянтной емкости системы протеина С;
-
Тромбинемия, маркером которой является повышенное содержание растворимых фибринмономерных комплексов (РФМК).
-
Радикальное снижение фибринолитической активности плазмы крови.
Даже одного из обнаруженных изменений: например, только многократного повышения активности VIII-го фактора свёртывания, или только резистентности Va-фактора свёртываемости в системе протеина С, или только выраженного снижения фибринолитической активности, уже достаточно для многократного повышения у пациента риск венозных тромбоэмболических осложнений (ВТЭО). Нужно учитывать и суммарный, аддитивный эффект этих нарушений.
И, помимо этого, у пациента изменены реологические свойства плазмы крови, вязкость которой значительно повышена из-за присутствия высокомолекулярных парапротеинов. Как очевидно, повышение вязкости крови значительно увеличивает риски тромбообразования.
Вернемся к тромбоцитам
Как мы уже отметили выше, обычное исследование их индуцированной агрегантной активности оптическим методом (по Борну) мало говорит о каких-либо рисках.
В данном случае неоценимую помощь оказывает проточная (или потоковая) агрегатометрия в условиях гемодинамического сдвига. Технология основана на пропускании потока цельной крови под давлением через отверстие малого диаметра, имитирующее просвет сосуда. При этом тромбоциты, также подвергаясь действию эндогенных индукторов агрегации, не изолированы, но находятся в условиях клеточного окружения, в потоке крови, под действием других факторов свёртывания. Это максимально приближает исследование к физиологическим условиям.
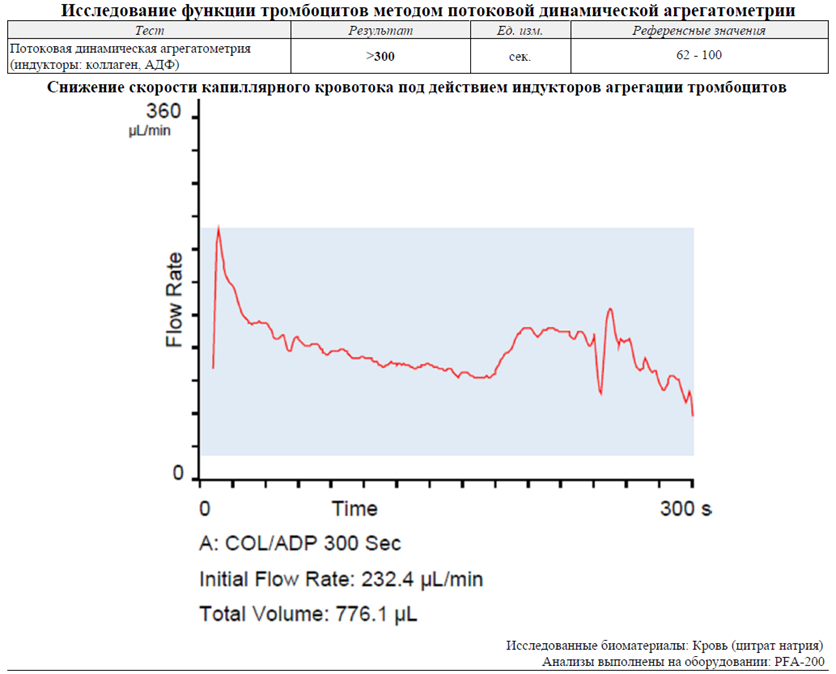
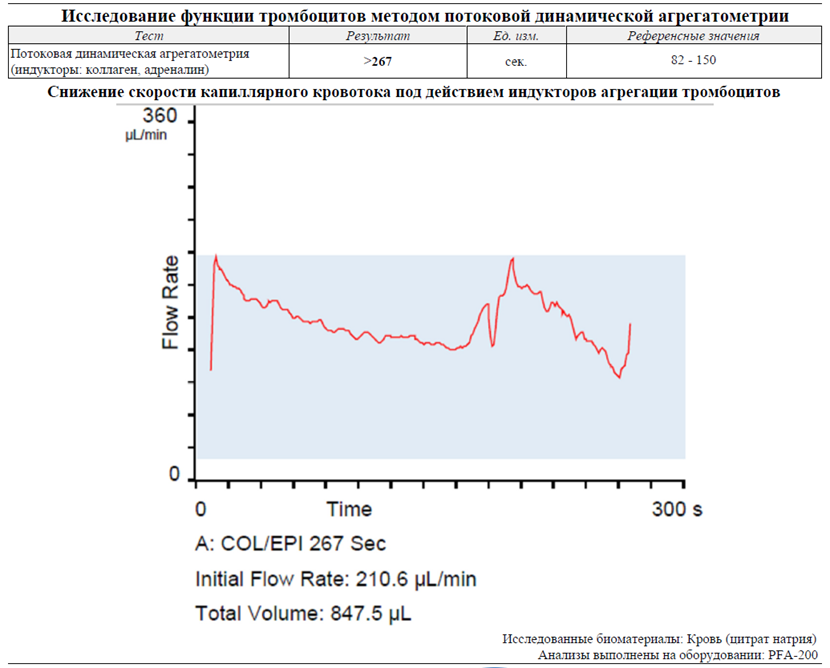
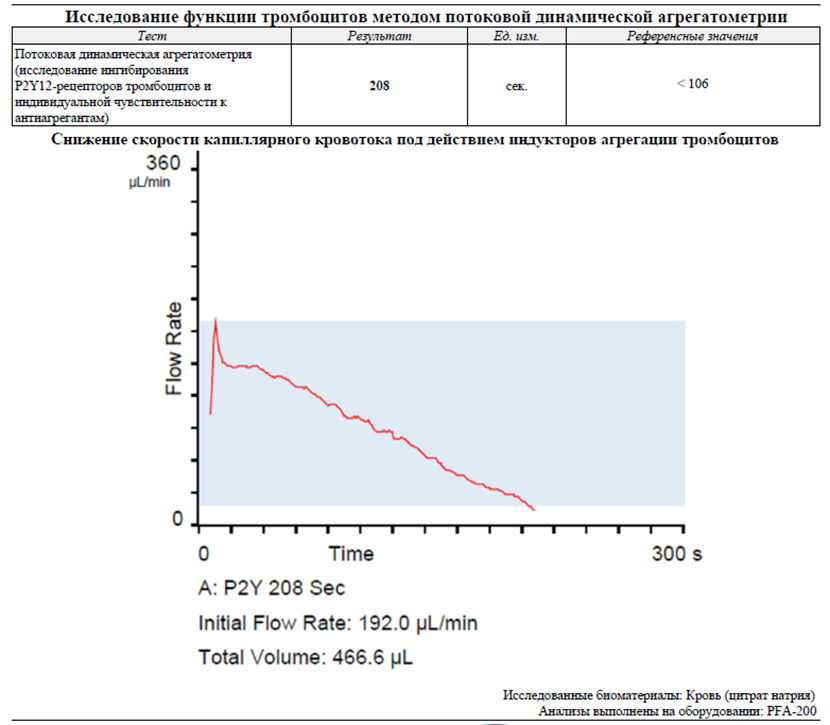
Как мы видим, окклюзия отверстия, имитирующего просвет сосуда, протекает со значительным замедлением и фактически не происходит. Результат преимущественно обусловлен тромбоцитопенией, а не только изменением агрегантной активности тромбоцитов. Тромбоцитарное звено гемостаза у пациента практически не работает, что говорит о риске развития геморрагического синдрома по микроциркуляторному типу.
Выводы
Таким образом, у пациента одновременно присутствует серьезный риск венозных тромбоэмболических осложнений и риск развития геморрагического синдрома, связанный с угнетением сосудисто-тромбоцитарного гемостаза.
Существует некоторый «коридор», находясь в котором мы исключаем развитие как тромбофилии, так и геморрагического синдрома. В описанном клиническом случае этот «коридор» очень узкий. Что это означает на практике?
Проведение антикоагулянтной терапии для профилактики венозных тромболических осложнений у пациента может легко спровоцировать развитие геморрагического синдрома. Но отказ от антикоагулянтной терапии с высокой вероятностью приведет к развитию венозных тромбоэмболических осложнений или диссеминированного внутрисосудистого свертывания.
При этом полученные результаты однозначно исключают возможность какой-либо антиагрегантной терапии, которая в данном случае категорически противопоказана.
В заключение ещё раз обращаем внимание на важность развернутых, комплексных исследований системы гемостаза. Описанный клинический случай хорошо иллюстрирует справедливость и обоснованность такой диагностической тактики.
Опираясь на стандартные клинические рекомендации и скудные литературные данные, ограничиваясь только исследованием параметров тромбодинамики, тромбоэластографии и агрегантной активности тромбоцитов, выявить все упомянутые риски было бы невозможно.



